Fazy badania klinicznego
Data aktualizacji: 2024-12-24
Badania kliniczne są prowadzone według jasno ustalonych mechanizmów i zasad. Przestrzeganie ich jest niezbędne zarówno do utrzymania wysokich standardów jakościowych, jak również bezpieczeństwa pacjentów i skuteczności terapii. Wyróżniamy następujące fazy badania klinicznego:
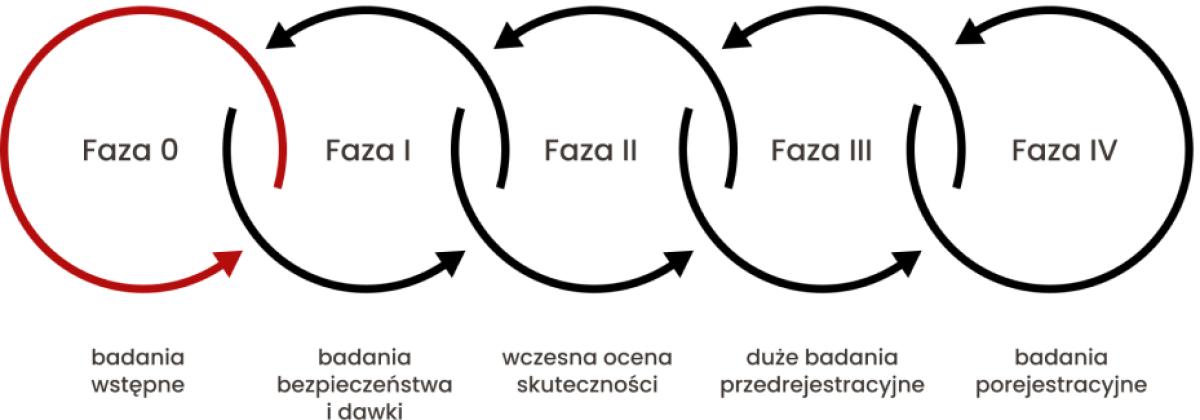
-
Treść
W fazie 0 sprawdza się, czy zachowanie leku w organizmie człowieka jest zgodne z przewidywaniami badań przedklinicznych, czyli badań prowadzonych na zwierzętach. Dzięki temu możliwa jest ocena toksyczności i uzyskanie podstawowych informacji dotyczących bezpieczeństwa danej cząsteczki. Jest to wstępne badanie fazy I, które nie ma celu terapeutycznego. Prowadzi się je na niewielkiej liczbie zdrowych ochotników, aby poznać mechanizm działania nowego, potencjalnego leku oraz uzyskać wstępne wyniki badań farmakokinetycznych (określających zmiany jakie lek przechodzi on w organizmie) i farmakodynamicznych (opisujących mechanizm jego działania). Do takiej weryfikacji wykorzystywana jest dawka określona przez Amerykańską Agencję ds. Żywności i Leków (ang. Food and Drug Administration, FDA) i wynosi 1/100 dawki badanej wyliczonej na podstawie badań przedklinicznych. Badania fazy 0 są badaniami wstępnymi, nie są wymagane, jednakże pozwalają na uzyskanie większej wiedzy na temat nowej substancji, w tym dotyczących wstępnych interakcji lekowych i populacji docelowej, różnych postaci leku czy jego stężenia w miejscu działania.
-
Treść
W fazie I produkt badany po raz pierwszy zostaje podany pacjentom. Badania tej fazy powinny dostarczyć odpowiedzi na kilka pytań:
- Czy produkt leczniczy jest relatywnie bezpieczny po podaniu pojedynczym i wielokrotnym?
- Jaka będzie stosowana początkowa (wyjściowa) dawka przy podaniu pacjentom w fazie II?
- Jaka jest farmakokinetyka produktu po podaniu pojedynczym i wielokrotnym?
Na tym etapie wskazane jest też uzyskanie informacji, jaka będzie docelowa populacja dla danego produktu.
Liczebność uczestników w fazie I jest niewielka i przeważnie wynosi mniej niż 100 osób. Ponadto w ramach tej fazy dla danego produktu przeprowadza się zazwyczaj kilka badań. Uczestnikami, z wyjątkiem sytuacji, gdy podanie byłoby nieetyczne (silnie działające produkty leki cytostatyczneprzeciwnowotworowe, psychotropowe czy też badania w zakresie intensywnej terapii lub reanimacji) są zdrowi uczestnicy. Otrzymują oni wynagrodzenie za udział w badaniu klinicznym wynagrodzenie. Jeśli badany produkt leczniczy podawany jest pacjentom, badanie planowane jest tak, aby już na tym etapie pacjent mógł odnieść korzyści terapeutyczne.
Zdarza się, że po przeprowadzeniu badań fazy I wraca się do etapu badań przedklinicznych, aby móc, na przykład, wyjaśnić poszczególne mechanizmy działania leku lub pracować nad jego formulacją (składem i postacią).
-
Treść
Kolejnym etapem badania klinicznego jest faza II, w której badany produkt podaje się po raz pierwszy pacjentom cierpiącym na konkretną chorobę, będącą przyszłym wskazaniem terapeutycznym.
Celem badań fazy II jest sprawdzenie poziomu bezpieczeństwa i skuteczności kilku dawek badanego produktu i wybranie tej dawki, która będzie badana w ramach fazy III. Na tym etapie w badaniu bierze udział od kilkudziesięciu do kilkuset pacjentów.
Zdarza się, że badania fazy II dzieli się na badania fazy IIA i IIB. Badania fazy IIA prowadzone są w celu doprecyzowania wyjściowej dawki nowego produktu, natomiast badania IIB w celu uzyskania wstępnych informacji na temat potencjalnej skuteczności nowego produktu.
Badania fazy II prowadzi się zazwyczaj z użyciem podwójnie ślepej próby (badanie, w którym zarówno uczestnik, badacz, jak i zespół badawczy nie wiedzą, który ze stosowanych w badaniu klinicznym sposobów leczenia otrzymuje uczestnik badania, czyli do jakiej grupy terapeutycznej jest przydzielony), w których badany produkt leczniczy porównuje się z placebo lub z lekiem będącym już na rynku. Podaje się go zazwyczaj przez kilka lub kilkanaście tygodni, w zależności od właściwości farmakologicznych badanego produktu, czyli znacznie krócej niż w przypadku badania fazy III. W szczególnych okolicznościach (brak odpowiedniego leku na rynku, uzyskanie bardzo dobrych wyników bezpieczeństwa i skuteczności) można rozpocząć proces rejestracji leku (tryb przyspieszony). Rejestracja w trybie przyspieszonym nie zwalnia Sponsora z przeprowadzenia badań fazy III.
-
Treść
W fazie III badacze ostatecznie potwierdzają efektywne działanie badanego produktu w danym wskazaniu. Celem jest weryfikacja, czy badany produkt jest skuteczniejszy od dotychczas stosowanego standardu z jednoczesnym sprawdzeniem bezpieczeństwa danej terapii. W fazie III potwierdza się skuteczność schematów dawkowania, gromadzi wiedzę na temat korzyści ze stosowania badanego produktu, a jednocześnie ustala przeciwwskazania do stosowania u osób z daną jednostką chorobową. Jest to etap weryfikujący efekty krótkotrwałego i długotrwałego stosowania badanego produktu leczniczego w grupie badanej. W związku z tym badanie kliniczne może trwać od roku do kilku lat.
Badania w tej fazie, podobnie jak w przypadku fazy II, są zaślepione — najczęściej metodą podwójnie ślepej próby. Stosowany jest losowy dobór pacjentów, a badanie prowadzone jest na dużej populacji chorych (kilkaset lub nawet kilka tysięcy osób). Badania III fazy, ze względu na stosunkowo długi czas trwania, a także na ich skalę, są najdroższe i najbardziej czasochłonne. Na tym etapie bardzo ważne jest efektywne zaprojektowanie, a następnie prowadzenie badań, gdzie istotne jest uwzględnienie czasu prowadzonej terapii, jej efektywności oraz bezpieczeństwa pacjenta.
Pozytywne zakończenie badania klinicznego fazy III daje możliwość rejestracji produktu leczniczego jako lek, a tym samym wprowadzenia go na rynek.
Zarejestrowanie nowego leku wymaga złożenia kompleksowej dokumentacji dotyczącej produktu badanego, w której zawarte są wszystkie dane zebrane w czasie badań przedklinicznych oraz badań fazy I, II i III. Zebrane materiały mogą liczyć nawet kilkanaście tysięcy stron, a szczegółowy zakres danych jest określany przez agencje rejestrujące poszczególnych krajów i podlega konsultacjom jeszcze przed rozpoczęciem programu badawczego. Dzięki temu bardzo precyzyjnie określani są docelowi uczestnicy badań, a ryzyko pominięcia istotnych analiz jest minimalizowane. W Polsce organem rejestrującym jest Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL).
-
Treść
Faza IV jest realizowana po rejestracji i dopuszczeniu leku do obrotu, dlatego określa się ją jako badanie porejestracyjne. Celem tego etapu jest ostateczne potwierdzenie, czy lek jest bezpieczny we wszystkich wskazaniach zaleconych przez producenta. Badanie odbywa się na dużej populacji, przy szczególnym uwzględnieniu długotrwałego stosowania, co pozwala na określenie interakcji z innymi lekami oraz identyfikację działań niepożądanych, które nie zostały wykryte wcześniej, m.in. ze względu na zbyt niską heterogenność (zróżnicowanie) grupy badanej czy niedostateczny czas na zaobserwowanie długofalowych efektów. Faza IV umożliwia również weryfikację wyników uzyskanych w poprzednich etapach badania klinicznego.

