Diagnostyka
Data aktualizacji: 2026-01-12
Rak jądra to choroba, którą można skutecznie wyleczyć, jeśli zostanie wcześnie wykryta. Dlatego diagnostyka jest kluczowa – pozwala nie tylko potwierdzić obecność nowotworu, ale też określić jego typ i stopień zaawansowania, co jest niezbędne do wyboru najlepszego leczenia. Podstawą jest wizyta u urologa, który dokładnie bada jądra, pachwiny i jamę brzuszną, a w razie nieprawidłowości zleca USG – bezbolesne badanie obrazowe pozwalające odróżnić zmiany łagodne od guzów nowotworowych. Kolejnym krokiem są badania krwi w kierunku markerów nowotworowych, a ostateczne potwierdzenie daje badanie histopatologiczne po chirurgicznym usunięciu jądra. Następnie wykonuje się badania obrazowe, aby sprawdzić, czy rak nie rozprzestrzenił się poza jądro, a lekarze określają stopień zaawansowania choroby i prognozę. Dzięki temu możliwe jest precyzyjne dobranie leczenia i monitorowanie jego skuteczności – każdy etap diagnostyki zwiększa szanse na pełne wyleczenie.
Diagnostyka raka jądra – krok po kroku
Diagnostyka raka jądra to wieloetapowy proces, który pozwala nie tylko potwierdzić obecność nowotworu, ale również określić jego rodzaj i stopień zaawansowania. Informacje te są kluczowe do zaplanowania najskuteczniejszego leczenia, które w przypadku raka jądra daje bardzo wysokie szanse na pełne wyleczenie.
Wizyta u lekarza (urologa)
Podstawą diagnostyki jest wizyta u lekarza (najlepiej urologa), która obejmuje:
- wywiad lekarski,
- badanie fizykalne, podczas którego lekarz dokładnie ogląda i bada oba jądra, ocenia ich wielkość, konsystencję oraz obecność guzków. Sprawdza również pachwiny i jamę brzuszną pod kątem powiększonych węzłów chłonnych.
Badanie USG
W przypadku wykrycia nieprawidłowości, kolejnym krokiem jest ultrasonografia (USG) moszny – bezbolesne i nieinwazyjne badanie obrazowe, które za pomocą fal dźwiękowych pozwala z dużą precyzją uwidocznić strukturę jąder. USG pozwala odróżnić guz lity, który może być nowotworem, od zmian o charakterze łagodnym, takich jak torbiele czy wodniaki. Badanie USG jest obowiązkowe nawet wtedy, gdy guz jest wyraźnie wyczuwalny w badaniu fizykalnym.
Badania krwi
W kolejnym kroku przeprowadza się badania krwi w celu oznaczenia stężenia tzw. markerów nowotworowych. Są to substancje białkowe, których poziom może być podwyższony w przypadku raka jądra. Główne markery to: alfa-fetoproteina (AFP), gonadotropina kosmówkowa (β-hCG), dehydrogenaza mleczanowa (LDH). Stężenie markerów jest ważne nie tylko dla postawienia diagnozy, ale także dla oceny stopnia zaawansowania choroby i późniejszego monitorowania skuteczności leczenia. Należy jednak pamiętać, że prawidłowe wartości markerów nie wykluczają obecności raka jądra, zwłaszcza w przypadku nasieniaków.
Badanie histopatologiczne
Pewne rozpoznanie raka jądra można postawić wyłącznie na podstawie badania histopatologicznego, czyli ocenie usuniętej zmiany pod mikroskopem. W tym celu wykonuje się zabieg chirurgiczny zwany orchidektomią, który polega na usunięciu całego jądra wraz z powrózkiem nasiennym przez nacięcie w pachwinie. Co ważne, w przypadku podejrzenia raka jądra nie wykonuje się standardowej biopsji przez skórę moszny, ponieważ niesie ryzyko rozsiewu komórek nowotworowych. Usunięte jądro jest badane przez patologa, który potwierdza diagnozę i określa typ nowotworu (nasieniak lub nienasieniak) oraz inne cechy mające wpływ na dalsze leczenie. U pacjentów z grupy podwyższonego ryzyka wystąpienia nowotworu w drugim jądrze, lekarz może zlecić biopsję drugiego, pozornie zdrowego jądra, by sprawdzić czy nie rozwija się w nim stan przedrakowy, zwany GCNIS (nowotworzenie germinalne in situ). Czynniki ryzyka, które mogą skłonić lekarza do rozważenia takiej biopsji, to m.in. mała objętość drugiego jądra, przebyte wnętrostwo czy problemy z płodnością.
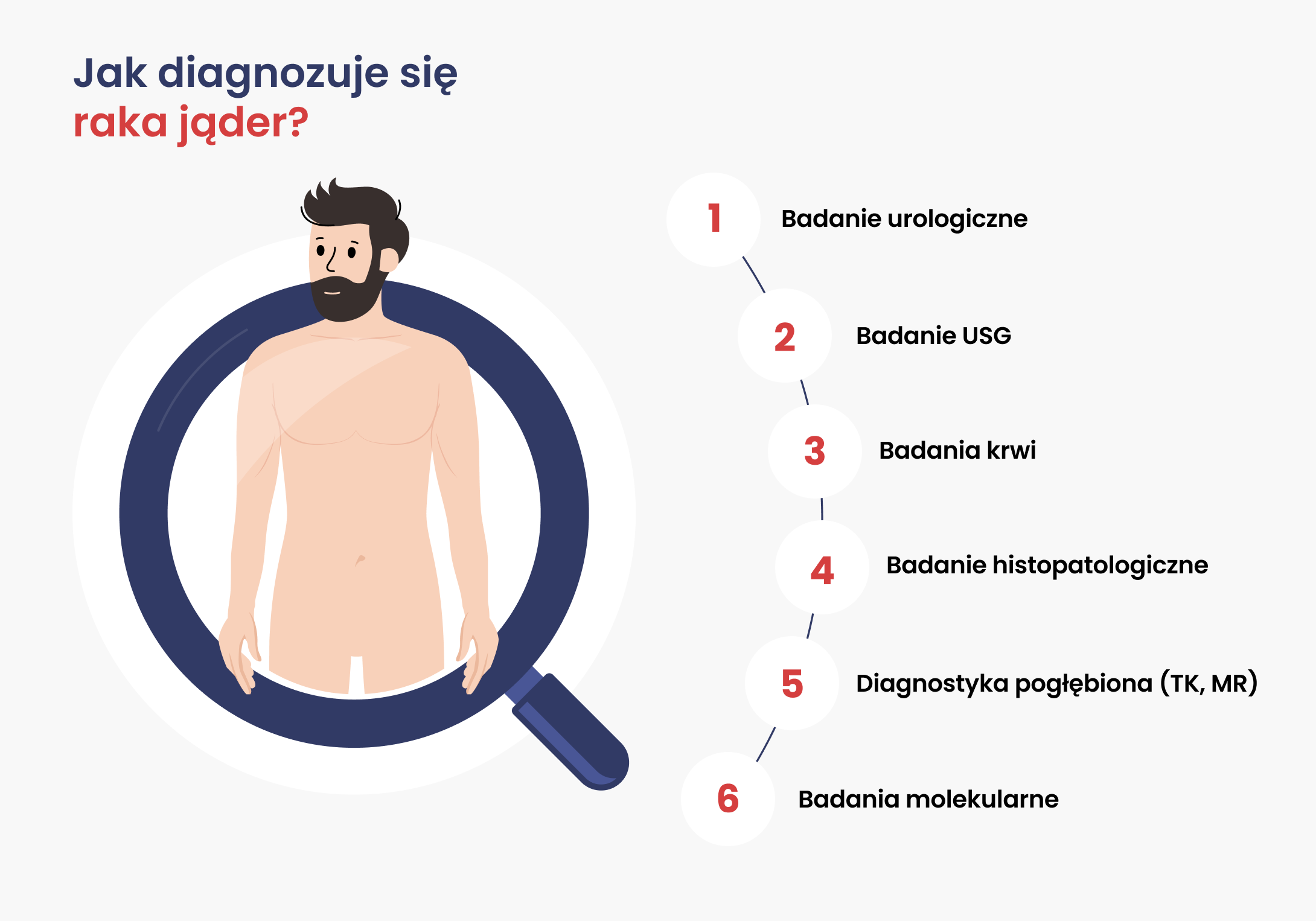
Diagnostyka pogłębiona – ocena stopnia zaawansowania
Po potwierdzeniu raka jądra wykonuje się badania obrazowe, które pozwalają ocenić, czy choroba nie rozprzestrzeniła się poza jądro.
Standardowo zlecana jest tomografia komputerowa (TK) jamy brzusznej, miednicy oraz klatki piersiowej.
Badanie to pozwala na ocenę węzłów chłonnych (zwłaszcza tych w przestrzeni zaotrzewnowej) oraz narządów, takich jak płuca czy wątroba, pod kątem ewentualnych przerzutów.
W niektórych, rzadkich przypadkach, zwłaszcza u pacjentów z grupy wysokiego ryzyka i z objawami neurologicznymi, lekarz może zlecić wykonanie rezonansu magnetycznego (MR) mózgu.
Po zebraniu wszystkich wyników: badania fizykalnego, markerów nowotworowych, wyniku badania histopatologicznego oraz badań obrazowych, zespół lekarski określa stopień zaawansowania choroby. Na tej podstawie podejmowana jest decyzja o dalszym postępowaniu, które może obejmować obserwację, chemioterapię lub radioterapię.
Badania molekularne – kiedy i dla kogo?
Badania molekularne nie są rutynową częścią diagnostyki większości pacjentów z rakiem jądra. Ich celem jest znalezienie tak zwanych "mutacji podatnych na leczenie", które otwierają drogę do zastosowania nowoczesnych, spersonalizowanych terapii. Są stosowane u wybranych chorych, u których wyczerpano standardowe możliwości leczenia.
Rozważa się je u osób:
- z chorobą, która postępuje pomimo zastosowania standardowej chemioterapii (pierwszej i drugiej linii);
- u których doszło do nawrotu choroby po leczeniu, w tym po chemioterapii wysokodawkowej;
- u osób, które nie kwalifikują się do dalszego standardowego leczenia lub u których takie leczenie prawdopodobnie nie przyniesie już korzyści.
Jak określa się stopień zaawansowania choroby? Klasyfikacja TNM i S
Precyzyjna ocena stopnia zaawansowania choroby (ang. staging) jest kluczowa dla wyboru najskuteczniejszego leczenia i określenia rokowania. W raku jądra stosuje się międzynarodową klasyfikację TNM + S, która pozwala precyzyjnie opisać, jak bardzo nowotwór rozrósł się w miejscu pierwotnym i czy rozprzestrzenił się na inne części ciała i uwzględnia ona:
- T (Tumor) – Guz pierwotny: Opisuje, jak bardzo guz nowotworowy nacieka na struktury wewnątrz jądra i jego otoczenia. Ocenia się, czy jest ograniczony do jądra, czy nacieka na naczynia krwionośne, najądrze, powrózek nasienny lub skórę moszny.
- N (Nodes) – Węzły chłonne: Określa, czy nowotwór dał przerzuty do okolicznych węzłów chłonnych, które w przypadku raka jądra znajdują się w jamie brzusznej (w tzw. przestrzeni zaotrzewnowej). Ocenia się liczbę i wielkość zajętych węzłów.
- M (Metastases) – Przerzuty odległe: Wskazuje, czy komórki nowotworowe rozprzestrzeniły się poza węzły chłonne do odległych narządów, takich jak płuca, wątroba, kości czy mózg.
- S (Serum) – Markery nowotworowe: To unikalny element klasyfikacji raka jądra. Ocenia się stężenie markerów nowotworowych (AFP, beta-hCG, LDH) we krwi po usunięciu jądra. Poziom tych markerów jest niezwykle ważnym czynnikiem prognostycznym.
Klasyfikacja prognostyczna
Na podstawie TNM i S lekarze tworzą prostszą, numeryczną klasyfikację stopni zaawansowania, która jest łatwiejsza do zrozumienia dla pacjentów.
-
Stadium 0 (stan przedrakowy)
Oficjalna nazwa to nowotworzenie germinalne in situ (GCNIS) lub rak wewnątrzkanalikowy (pTis). To najwcześniejsza, nieinwazyjna postać choroby. Nieprawidłowe komórki nowotworowe znajdują się wyłącznie wewnątrz kanalików nasiennych w jądrze i nie rozprzestrzeniły się poza nie. To stan przedrakowy, który nieleczony może w ciągu kilku lat przekształcić się w inwazyjnego raka.
-
Stadium I (choroba ograniczona do jądra)
Nowotwór znajduje się wyłącznie w obrębie usuniętego chirurgicznie jądra. Badania obrazowe (tomografia komputerowa) nie wykazują przerzutów w węzłach chłonnych ani w narządach odległych, a markery nowotworowe po operacji wracają do normy.
- Stadium I A → Guz jest ograniczony do jądra i nie stwierdza się naciekania na naczynia krwionośne lub chłonne.
- Stadium I B → Guz jest bardziej zaawansowany miejscowo – nacieka na naczynia, najądrze, osłonki jądra, mosznę lub powrózek nasienny.
- Stadium I S → To szczególna kategoria. Po usunięciu jądra markery nowotworowe we krwi pozostają podwyższone lub ich poziom rośnie. Oznacza to, że w organizmie, mimo braku widocznych zmian w badaniach obrazowych, znajdują się ukryte mikroprzerzuty. Taki stan jest leczony jak choroba przerzutowa.
-
Stadium II (przerzuty do węzłów chłonnych w jamie brzusznej)
Nowotwór rozprzestrzenił się do węzłów chłonnych zaotrzewnowych w jamie brzusznej, ale nie ma przerzutów w narządach odległych (np. w płucach). W tym stadium poziom markerów nowotworowych może być w normie lub podwyższony. Dzieli się je w zależności od wielkości i liczby przerzutów do węzłów chłonnych - na stadium IIA, IIB i IIC.
-
Stadium III (przerzuty odległe)
Choroba jest najbardziej zaawansowana. Nowotwór rozprzestrzenił się poza węzły chłonne jamy brzusznej do odległych części ciała.
- Stadium III A → Przerzuty znajdują się w odległych węzłach chłonnych (np. w klatce piersiowej) lub w płucach, a poziom markerów nowotworowych jest prawidłowy lub nieznacznie podwyższony.
- Stadium III B → Przerzuty jak wyżej, ale z umiarkowanie podwyższonymi markerami nowotworowymi.
- Stadium III C → Najbardziej zaawansowana postać choroby, stwierdzana jest kiedy występują przerzuty w narządach innych niż płuca (np. w wątrobie, kościach, mózgu), lub przy bardzo wysokim poziomie markerów nowotworowych, niezależnie od lokalizacji przerzutów.
Klasyfikacja prognostyczna IGCCCG (International Germ Cell Cancer Collaborative Group)
Dla pacjentów z chorobą zaawansowaną, stosuje się dodatkową, niezwykle ważną klasyfikację rokowniczą IGCCCG. Dzieli ona pacjentów na grupy:
- dobrego,
- pośredniego i
- złego rokowania.
Klasyfikacja ta bierze pod uwagę nie tylko stopień zaawansowania TNMS, ale również typ nowotworu (nasieniak vs nienasieniak) oraz poziom markerów nowotworowych. Na tej podstawie planuje się intensywność chemioterapii. Nienasieniaki (Non-seminoma) mogą być zaklasyfikowane do każdej z trzech grup (dobrego, pośredniego lub złego rokowania). Z kolei nasieniaki (Seminoma) zawsze należą do grupy dobrego lub pośredniego rokowania. Nie ma grupy "złego rokowania" dla nasieniaków.
Źródła:
- Testicular Cancer Canada. (2023). Sexual health & testicular cancer: Patient guide (English version)., from https://www.urologyhealth.org/educational-resources/testicular-cancer-what-you-should-know-patient-guide [23.06.2025r]
- Oldenburg, J., Berney, D. M., Bokemeyer, C., Climent, M. A., Daugaard, G., Gietema, J. A., ... & Powles, T. (2022). Testicular seminoma and non-seminoma: ESMO-EURACAN Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology, 33(4), 362-375.
- European Association of Urology. (2024). EAU Guidelines on Testicular Cancer., from https://uroweb.org/guidelines/testicular-cancer [23.06.2025r]
- National Comprehensive Cancer Network. Testicular Cancer, Version 2.2025 — March 25, 2025, https://www.nccn.org/professionals/physician_gls/pdf/testicular.pdf [25.06.2025].
- European Society for Medical Oncology. Testicular Cancer: A Guide for Patients. from https://www.esmo.org/for-patients/patient-guides/testicular-cancer [25.04.2025].

