Diagnostyka
Data aktualizacji: 2025-02-18
Pomimo coraz lepszego dostępu do badań profilaktycznych w kierunku raka piersi, takich jak mammografia czy USG, wiele kobiet zgłasza się do lekarza dopiero wtedy, gdy zauważą niepokojące objawy. Wczesne rozpoznanie choroby daje największe szanse na skuteczne leczenie, dlatego tak ważna jest szybka i dokładna diagnostyka.
W tym artykule dowiesz się, jakie są etapy diagnozowania raka piersi, jakie badania są wykonywane oraz jakie znaczenie mają wyniki tych badań dla dalszego leczenia. Przedstawimy również, czym różnią się poszczególne typy raka piersi i jakie informacje można uzyskać dzięki badaniom genetycznym.
Co dzieje się po zauważeniu objawów?
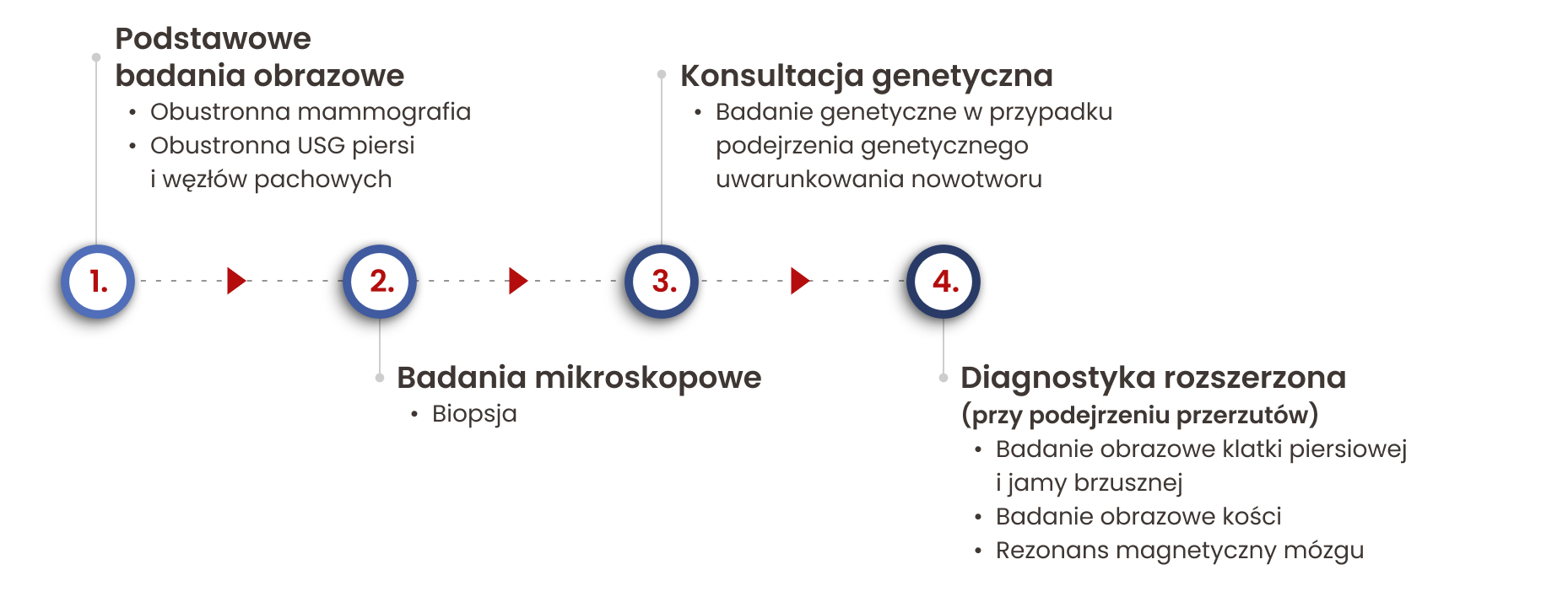
Pomimo coraz szerszej dostępności badań profilaktycznych, wciąż wiele chorych trafia do lekarza dopiero w momencie wystąpienia objawów wskazujących na obecność nowotworu. Postępowanie w tej grupie może różnić się w zależności od indywidualnych cech pacjentki, a w szczególności od wieku. Niezmiennie pierwszym krokiem będzie zebranie wywiadu oraz badanie palpacyjne (poprzez dotyk), pozwalające na wyczucie potencjalnych guzów nowotworowych.
Mammografia i USG — kiedy i dla kogo?
Mammografia to jedno z najważniejszych badań w diagnostyce raka piersi. Polega na wykonaniu zdjęć rentgenowskich piersi, które pozwalają uwidocznić nawet bardzo drobne zmiany w strukturze tkanki gruczołowej, takie jak guzki czy zwapnienia. Dzięki swojej wysokiej czułości, mammografia jest powszechnie stosowana jako badanie przesiewowe, pozwalające na wykrycie choroby przed wystąpieniem objawów klinicznych.
W przypadku podejrzanej zmiany mammografię zazwyczaj uzupełnia się badaniem USG piersi i oceną pachowych węzłów chłonnych, co zwiększa dokładność diagnostyczną.
Szczególnie istotną rolę w ocenie piersi pełni badanie ultrasonograficzne (USG), zwłaszcza w następujących sytuacjach:
- jako podstawowe badanie u młodych kobiet, u których piersi mają dużą gęstość, co utrudnia ocenę w badaniu mammograficznym,
- jako uzupełnienie mammografii — umożliwia dokładniejsze rozróżnienie zmian torbielowatych (zawierających płyn) od litych oraz precyzyjniejszą ocenę ich wielkości i granic,
- jako badanie obrazowe wspomagające wykonanie biopsji, pomagające precyzyjnie zlokalizować guz,
- jako metodę oceny pachowych węzłów chłonnych, chociaż w razie podejrzenia ich zajęcia przez nowotwór, decydujące znaczenie ma wynik biopsji.
Ze względu na niską czułość diagnostyczną, czyli ujemny wynik badania pomimo rozwijającej się choroby, markery nowotworowe (specjalne wskaźniki w badaniu krwi mające związek z nowotworem) już od wielu lat nie mają znaczenia w rozpoznawaniu raka piersi.
Biopsja: kluczowe badanie w potwierdzeniu diagnozy
Jeśli mammografia i USG wykazują zmiany budzące podejrzenie nowotworu, kolejnym krokiem diagnostycznym jest biopsja. Polega ono na pobraniu próbki tkanki z podejrzanego obszaru w celu przeprowadzenia analizy histopatologicznej, która pozwala jednoznacznie potwierdzić lub wykluczyć obecność komórek nowotworowych.
Biopsję gruboigłową wykonuje się zwykle pod kontrolą USG lub mammografii, jeszcze przed rozpoczęciem leczenia. Badaniu mogą zostać poddane również pachowe węzły chłonne, jeśli istnieje podejrzenie ich zajęcia przez chorobę. Tylko wynik badania mikroskopowego pozwala na postawienie ostatecznej diagnozy i zaplanowanie odpowiedniego leczenia.

Czy jesteś w grupie ryzyka? Kiedy należy zrobić badania genetyczne
Wszystkie pacjentki z rozpoznaniem złośliwego nowotworu piersi mogą skorzystać z konsultacji w ramach „Opieki nad rodzinami wysokiego, dziedzicznie uwarunkowanego ryzyka zachorowania na raka piersi lub raka jajnika”. To przede wszystkim wskazane u chorych z obciążonym wywiadem rodzinnym lub innymi czynnikami wskazującymi na możliwość genetycznego uwarunkowania nowotworu, zwłaszcza gdy w rodzinie występuje kilka przypadków raka piersi lub jajnika, w szczególności w młodym wieku.
Analiza genów związanych z rozwojem raka piersi pozwala ocenić ryzyko zachorowania na ten nowotwór. Szczególne znaczenie mają geny BRCA1 i BRCA2 — wśród osób, które odziedziczyły ich nieprawidłowe wersje ryzyko rozwoju raka piersi w ciągu całego życia może wynosić nawet 80%. Informacje uzyskane dzięki badaniom genetycznym są bardzo ważne przy wyborze najlepszego sposobu leczenia, planowaniu dalszego postępowania po zakończeniu terapii oraz podejmowaniu działań profilaktycznych, które mogą zmniejszyć ryzyko kolejnego nowotworu.
Rozszerzona diagnostyka: gdy rak może być bardziej zaawansowany
W przypadku miejscowo zaawansowanego raka piersi (III stopień zaawansowania) konieczne może być przeprowadzenie dodatkowych badań obrazowych, aby sprawdzić, czy choroba rozprzestrzeniła się na inne narządy. Rak piersi może tworzyć przerzuty do różnych części ciała, dlatego diagnostyka na tym etapie może obejmować:
- tomografię komputerową lub zdjęcie rentgenowskie klatki piersiowej,
- tomografię komputerową jamy brzusznej i miednicy lub badanie USG jamy brzusznej,
- scyntygrafię kości — badanie wykorzystujące pierwiastki promieniotwórcze w celu wykrycia ewentualnych przerzutów do kości.
Jeśli występują objawy sugerujące zajęcie ośrodkowego układu nerwowego, zaleca się również wykonanie rezonansu magnetycznego mózgu.

Podtypy raka piersi — nie każdy rak jest taki sam
Rak piersi nie jest jednorodną chorobą — wyróżnia się cztery podstawowe podtypy biologiczne, klasyfikowane na podstawie ekspresji (czyli obecności na powierzchni komórek nowotworowych) określonych receptorów białkowych (fragmentów komórki, które reagują na określone związki). Podział ten opiera się na wynikach badań histopatologicznych, które oceniają obecność receptorów hormonalnych — estrogenowego (ER) i progesteronowego (PgR) — oraz receptora ludzkiego naskórkowego czynnika wzrostu (HER2).
Receptor estrogenowy (ER) występuje u około 70–75% przypadków inwazyjnego raka piersi, a receptor progesteronowy obecny jest u ponad 50% pacjentek, u których obecny jest receptor estrogenowy i niezwykle rzadko stwierdzana jest samodzielnie, w rakach ER-ujemnych. Wysoka ekspresja receptorów hormonalnych wiąże się z korzystniejszym rokowaniem, dłuższym czasem przeżycia całkowitego i dłuższym okresem wolnym od nawrotu choroby. Z kolei niski poziom receptora progesteronowego może świadczyć o bardziej agresywnym przebiegiem choroby oraz wyższym ryzykiem wystąpienia nawrotu.
Z kolei ekspresja naskórkowego czynnika wzrostu (ang. human epidermal growth factor receptor 2, HER2) występuje u 15–20% pacjentek z rakiem piersi. HER2-ujemność lub -dodatniość odgrywa kluczową rolę w kwalifikacji pacjentek do leczenia celowanego. Nadmierna aktywność HER2 prowadzi do zwiększonej aktywacji szlaków sygnałowych, co sprzyja niekontrolowanemu wzrostowi komórek nowotworowych. Przed pojawieniem się terapii anty-HER2 rokowanie w tej grupie chorych było znacznie gorsze.
W diagnostyce raka piersi ocenia się również poziom Ki67, czyli markera proliferacji komórkowej, który odzwierciedla tempo podziału komórek nowotworowych. Im wyższy poziom Ki67, tym bardziej agresywny charakter nowotworu. Znaczenie tego wskaźnika jest szczególnie wyraźne w rakach hormonozależnych, natomiast w podtypach HER2-dodatnich i potrójnie ujemnych jego wartość prognostyczna jest mniej jednoznaczna. Kolejnym czynnikiem rokowniczym jest stopień złośliwości histologicznej (cecha G). W przypadku raków luminalnych (hormonozależnych), wysoki stopień złośliwości (G3) wiąże się ze zwiększonym ryzykiem nawrotu.
Wytyczne postępowania diagnostyczno-terapeutycznego u chorych na nowotwory piersi opracowane w ramach NSO
[1] Wojciechowska U, Barańska K, Miklewska M, Didkowska JA. Cancer incidence and mortality in Poland in 2020. Nowotwory. Journal of Oncology 2023;73(3):129-145. DOI: https://doi.org/10.5603/NJO.2023.0026
[2] National Comprehensive Cancer Network. Colon Cancer. Poland Edition (Version 4.2024) [ Internet]. 2024 [24.02.2025]. https://nio.gov.pl/wp-content/uploads/2024/11/Wytyczne-postepowania-diagnostyczno-terapeutycznego-w-raku-piersi-Breast-Cancer-%E2%80%93-Poland_aktualizacja-4.2024.pdf
[3] Jassem J, Krzakowski M, Bobek-Billewicz B, Duchnowska R, Jeziorski A, Senkus-Konefka E, et al. Rak piersi. Onkologia w Praktyce Klinicznej-Edukacja; 2020:6(5): 297–256.
[4] Lumachi F, Brunello A, Maruzzo M, Basso U, Basso SM. Treatment of estrogen receptor-positive breast cancer. Curr Med Chem. 2013;20(5):596-604. doi: 10.2174/092986713804999303. PMID: 23278394.
[5] Bardou VJ, Arpino G, Elledge RM, Osborne CK, Clark GM. Progesterone receptor status significantly improves outcome prediction over estrogen receptor status alone for adjuvant endocrine therapy in two large breast cancer databases. J Clin Oncol. 2003 May 15;21(10):1973-9. doi: 10.1200/JCO.2003.09.099. PMID: 12743151.
[6] Purdie CA, Quinlan P, Jordan LB, Ashfield A, Ogston S, Dewar JA, Thompson AM. Progesterone receptor expression is an independent prognostic variable in early breast cancer: a population-based study. Br J Cancer. 2014 Feb 4;110(3):565-72. doi: 10.1038/bjc.2013.756. Epub 2013 Dec 3. PMID: 24300977
[7] Rakha EA, Starczynski J, Lee AH, Ellis IO. The updated ASCO/CAP guideline recommendations for HER2 testing in the management of invasive breast cancer: a critical review of their implications for routine practice. Histopathology. 2014 Apr;64(5):609-15. doi: 10.1111/his.12357. Epub 2014 Jan 31. PMID: 24382093.
[8] Krishnamurti U, Hammers JL, Atem FD, Storto PD, Silverman JF. Poor prognostic significance of unamplified chromosome 17 polysomy in invasive breast carcinoma. Mod Pathol. 2009 Aug;22(8):1044-8. doi: 10.1038/modpathol.2009.61. Epub 2009 Apr 24. PMID: 19396150.
[9] Finkelman BS, Zhang H, Hicks DG, Turner BM. The Evolution of Ki-67 and Breast Carcinoma: Past Observations, Present Directions, and Future Considerations. Cancers (Basel). 2023 Jan 28;15(3):808. doi: 10.3390/cancers15030808. PMID: 36765765
[10] Inic Z, Zegarac M, Inic M, Markovic I, Kozomara Z, Djurisic I, Inic I, Pupic G, Jancic S. Difference between Luminal A and Luminal B Subtypes According to Ki-67, Tumor Size, and Progesterone Receptor Negativity Providing Prognostic Information. Clin Med Insights Oncol. 2014 Sep 11;8:107-11. doi: 10.4137/CMO.S18006. PMID: 25249766

